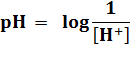|
|||||||||||||||||||||||||||||||||||
![]()
Indicateur ancien
|
La
solution bleue de sirop de violettes
devient rouge en présence d'acide et verte en présence d'alcali. Robert
Boyle (1627-1691) explique en 1663 comment mettre en évidence le caractère
acide des solutions à l’aide de sirop de violette déposé sur un papier blanc,
précurseur du papier-pH… |
|
|
|
|
Acide
et base
Eau
pure et solution aqueuse
pH
Le pH vaut le logarithme de
l'inverse (cologarithme) de la concentration en ion H+ dans la
solution.
|
|
|
|
|
|
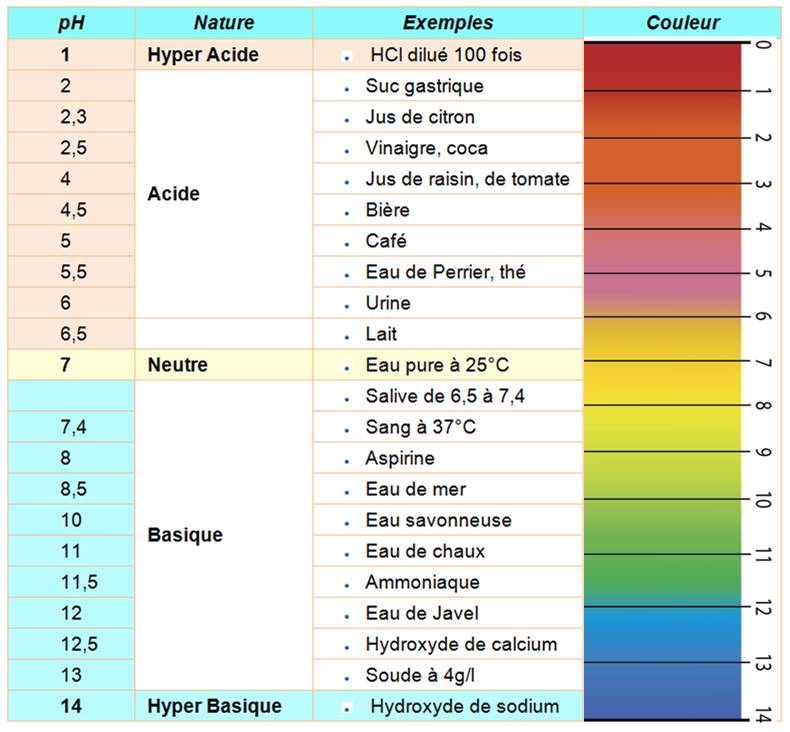
Acide: beaucoup d'ions H+ Mnémotechnique: on commence
par A de Acide comme pour l'alphabet: très acide vaut 1, 2, 3 … Ou aussi: on trouve Acide
puis Base par ordre alphabétique.
Le pH du tube digestif de l'homme et
des animaux supérieur est acide. Celui des insectes est basique. |
|
Note
![]()
Principaux acides et bases
|
|
|
|
Une réaction acide-base implique le
transfert d'un proton (H+)
d'un acide vers une base. Sauf cas spécifiques, ceci est la définition de
l'acide (Brønsted-Lowry).
|
|
|
Acide |
Formule |
Usages – Commentaires |
|
Oxalique |
C2
H4O4 |
Nommé sel de citron lorsqu'il est sous
forme de cristaux. Un des acides organiques les plus forts. Traitement de surface des métaux. Agent de blanchiment des textiles, du bois,
des cuirs. Retrait des traces de rouille |
|
Acétique |
C2
H4O2 |
Acide du vinaigre, des saumures. Pour la fermentation des aliments. |
|
Pyruvique |
C3H4O3 |
Métabolisme des cellules vivantes (respiration
cellulaire). |
|
Lactique |
C3H6O3 |
Présent dans le lait, le vin, fruits,
légumes … Produit clé de la production d'énergie par les muscles. |
|
Tartrique |
C4H6O6 |
Présent dans de nombreuses plantes. C'est le principal acide du vin, provenant
du raisin. |
|
Ascorbique |
C6H8O6 |
Antioxydant. Présent dans le citron, les légumes frais,
les jus de fruit. |
|
Citrique |
C6H8O7 |
Acide des citrons. Métabolisme ses êtres vivants. |
|
Gluconique |
C6H12O7 |
Très répandu chez les animaux et les
plantes. Moûts des vins. |
|
Acétylsalicylique |
C9H8O4 |
Aspirine. |
|
Formique |
H2CO2 |
Acide méthanoïque. Présents dans les glandes de certains hyménoptères:
fourmis et des abeilles; aussi sur les feuilles d'orties. Utilisation; textiles, insecticide, laque
... |
|
Carbonique |
H2CO3 |
Acidification des océans du fait de l'augmentation du CO2 Limonade, sodas. Active le passage de l'estomac vers les
intestins. Conservation de la viande. |
|
Sulfurique |
H2SO4 |
Dans les batteries
de voiture. Fabrication des plastiques, insecticides,
détergents. Produits pharmaceutiques. |
|
Phosphorique |
H3PO4 |
Transporteur d'énergie (biologie). Régulateur de pH dans les sodas. |
|
Chlorhydrique |
HCl |
Produit dans l'estomac. Nettoyant des dalles et du béton. |
|
Nitrique |
HNO3 |
Gravure du cuivre. Fabrication d'engrais. |
Voir Acides
aminés / Acides nucléiques / Acide hyaluronique / Acides et bases
|
|
|
|
Produit chimique qui, à l'inverse d'un
acide, est capable de capturer un ou plusieurs protons ou, réciproquement, de
fournir des électrons.
|
|
|
Base |
Formule |
Usages – Commentaires |
|
Hydroxyde
de baryum |
Ba(OH)2 |
Titrage des acides faibles. Synthèse organique (esters). |
|
Chaux
éteinte |
Ca(OH)2 |
Hydroxyde de calcium. Additif alimentaire. Floculation dans les circuits d'égout. Fabrication du papier (procédé Kraft) |
|
Chaux
vive |
CaO |
Carbonate de calcium. Réagit violemment avec l'eau. Nombreux composés chimiques. |
|
Potasse
caustique |
KOH |
Hydroxyde de potassium Savon, engrais. Piles alcalines. |
|
Hydroxyde
de lithium |
LiOH |
Proche de la soude ou de la potasse. Purification de l'air des sous-marins. Synthèse des polymères. |
|
Magnésie |
MgO |
Oxyde de magnésium. Très fortement basique. Absorbe l'eau et le dioxyde de carbone
présents dans l'atmosphère. Pigment pour les peintures. |
|
Lait
de magnésie |
Mg(OH)2 |
Hydroxyde de magnésium. Antiacide gastrique, laxatif. |
|
Carbonate
de sodium |
Na2CO3 |
Fabrication du verre. Lessives. Fabrication du bicarbonate de sodium (NaHCO3). Additif alimentaire. |
|
Soude (caustique) |
NaOH |
Hydroxyde de sodium. Déboucheur de canalisation. Production de nombreux produis: papier,
plastiques, savons et détergents … Régulation du pH. |
|
Ammoniaque |
NH3 |
Ammoniaque (NH4OH): solution
aqueuse de gaz ammoniac (NH3). |
|
Oxyde
de plomb |
PbO |
Peintures. Anode des batteries. |
![]()
|
Suite |
|
|
Voir |
|
|
DicoNombre |
|
|
Site |
|
|
Cette page |
![]()