|
|||||||||||||||||||||||||||||||||||||||||
![]()
|
NUCLÉONS Neutrons & Protons Un
couple de particules au cœur du noyau atomique, chacun formé de 3 quarks. Combien sont-ils dans l'Univers ? Un
atome d'hydrogène comprend un
électron et un proton comme seul constituant du noyau. L'électron s'en va,
reste le proton qui n'est rien d'autre que l'ion H+. Le noyau est 200 000 milliards de fois plus dense que
l'eau. Taille de l'atome: 10-10
mètre. Taille du noyau:
100 000 fois plus petit (10-15 m). 99,999999999999
%
de vide dans l'atome. Le noyau
dans l'atome: une orange au centre d'une très grande place circulaire. Le noyau concentre
99,9 % de la masse de l'atome et n'occupe qu'une place infime (rapport: 10-15 / 10-10 = 10-5). |
Voir Matière / Couches électroniques / Pauli et neutrino / Pauli et 137
|
|
|||
|
Si
on imagine
Historique
|
|||
|
|
||||
|
FERMION Composant la
matière |
|
LEPTON => |
Électron |
|
|
HADRON Sensible à la
force nucléaire forte |
BARYON = 3 quarks=> |
Proton |
||
|
Neutron |
||||
|
MÉSON => |
Pion |
|||
|
Quark et Antiquark |
|
|||
|
BOSON Liaison de la
matière |
|
|
Photon |
|
Voir Tableau
complet
|
|
||
|
Caractéristique |
Valeur |
|
|
Diamètre du neutron et du proton; distance maximum
d'éloignement des quarks. |
10-15 m = 1 fermi >>> |
|
|
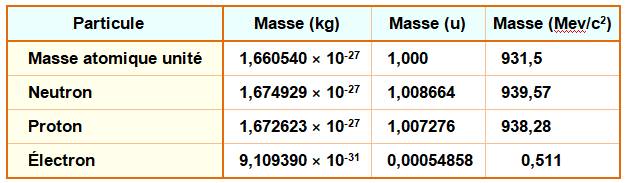
Masse du proton Masse du neutron |
précision
'10' 1,674 92 '86' 10-27 kg précision
'10' |
|
|
Masse de l'électron |
0,9… 10-30 kg Le
proton est 1 835 fois plus lourd que l'électron. |
|
|
Masse / Énergie du proton |
939,57 MeV – neutron 938,27 Mev – proton 1,3
MeV – écart |
|
|
Durée de vie du proton Durée de vie du neutron libre (en dehors
du noyau) – Mesuré en 2021. |
1030 ans 877,74 secondes |
|
Humour
|
Blague anglaise: A neutron walks into a bar, and asks: how much does a drink cost? The
bartender replies: For you, no charge. Traduction:
Un neutron entre dans un bar et demande: combien coûte une boisson ? The
barman répond: pour vous c'est gratuit (no charge). |
Voir Pensées & humour
|
|
|
|
Énergie de liaison nucléaire et défaut de masse
L'équation
d'Einstein relie l'énergie et la masse : E = mc². Conversion:
une masse de 1 u équivaut à une énergie de 931,5 MeV. Oups! y'a comme un défaut ! L'atome
de carbone 12 a une masse de 12 u, et pourtant il contient 6 protons et 6
neutrons qui ont chacun une masse supérieure à 1 u, sans compter une petite
contribution des 6 électrons. Cette
masse manquante est connue sous le nom de
défaut de masse et représente l'énergie de liaison
du noyau. L'énergie
de liaison est l'énergie dont vous auriez besoin pour diviser le noyau en
protons et neutrons individuels. Son
calcul: masses des protons + celles des neutrons + celles des électrons
individuels – masse de l'atome; puis, convertissez cette différence de masse
en énergie. Cas
du carbone 12: Différence de masse entre proton et neutron 1,293 332 36(46) MeV/c² |
|
Voir Fundamental
Physical Constants – NIST Refrence
|
|
|
|
0,
8418 femtomètre
(0,8418 10-15 m): nouvelle valeur.
En 2010, les mesures
semblent conférer une taille plus petite au proton. En 2013, nous en
sommes toujours là. Aucune faille théorique ni expérimentale. Faut-il
chercher une nouvelle interaction particulière due au muon? Peu probable.
Mais quel est le secret? En 2017, de nouvelles
mesures d'écarts d'énergie entre les niveaux des noyaux de l'atome de
deutérium confirment un écart avec les mesures précédentes de 4%. Le mystère
reste entier. |
|
|
|
|
|
136 x 2256 =
1,57 1079 » 1080 d'après un calcul d'Arthur Eddington (fin des
années 1930)
En
fait 1,16 1080, mais la précision n'est pas telle que l'on ait à
conserver cette valeur. |
|
Suite en Nombre d'atomes
|
|
|
|
La quantité des neutrons est variable |
|
|
|
|
|
* Chromodynamique quantique ou QCD pour Quantum ChromoDynamics.
Différence de masse Elle
doit être supérieure à la masse de l'électron: 0,51099906 MeV Inférieure:
formation abondante d'hélium, rendant
impossible la formation et la survie du Soleil. Supérieure:
impossibilité de réaliser la synthèse d'éléments
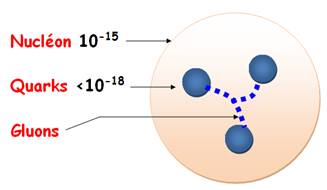
plus lourds que l'hydrogène. Effets des quarks Les
protons et les neutrons
(des hadrons) sont principalement constitués de
trois quarks chacun. Il faut y ajouter des
gluons, les particules véhiculant la force
forte, et des paires quark-antiquark qui
apparaissent et disparaissent en permanence. Neutron: deux quarks d et un
quark u Proton: un quark d et deux
quarks u quark d plus lourd que quark u Effet de l'énergie cinétique Les
quarks contribuent principalement à la masse par leur énergie cinétique et
par leurs interactions avec les gluons, les
particules qui véhiculent l'interaction forte
liant les quarks entre eux (cf. équivalence énergie-masse). |
|
Plus de détail sur
l'explication de la
différence de masse – Pour la Science 30/04/2015
|
|
||
|
|
|
|
|
-
l'antiquark se combine au quark libéré et forme
une particule (méson); -
le nouveau quark se recombine aux 2 précédents et
reforme le neutron.
|
||
|
|
|||||||||||||||||||
|
Durée de vie d'un proton: 1030 ans >>> Soit 1020
fois l'Âge
de l'univers!
Durée moyenne de vie du proton:
|
|||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||
|
* cet isotope de l'hydrogène est le
deutérium. |
|||||||||||||||||||||||||||||||||
![]()
|
Voir |
|
|
Aussi |
|
|
Diconombre |
|
|
Cette page |
![]()