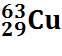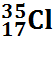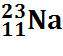|
||||||||||||||||||||||||||||
![]()
|
ATOME et structure atomique Spécial débutant. Notions du niveau de la classe de seconde. |
|
|
|||
|
Molécule |
|
||
|
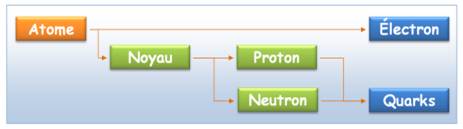
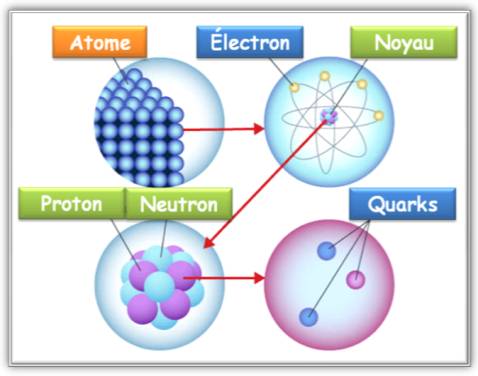
Atomes |
Si
l'atome mesurait 100 m de diamètre, le noyau serait de la taille d'une fourmi et l'électron de
celle d'une bactérie. Taille
de l'atome (rayon):
|
||
|
|
Représentation classique de l'atome:
l'échelle n'est pas respectée, le noyau est beaucoup plus petit; de même que
les électrons. Ceux-ci ont des trajectoires curieuses, régies par le hasard
et progressant sur plusieurs couches autour du noyau. |
|
|
|
Électron |
1
coulomb (C) = charges électriques qui
traversent un circuit de 1 ampère pendant une seconde. |
|
Noyau |
Taille
des nucléons: 1 femtomètre = 10-15 m |
|
Neutron |
|
|
Proton |
|
|
Quark |
|
|
|
Présentation linéaire
Présentation par zooms successifs
|
Voir Les autres particules élémentaires
|
|
|||
|
Électron |
|
9,109 x 10-31 kg – 1,602189 x 10 – 19 C |
|
|
Proton |
|
1,67265 x 10 – 27 kg 1,602189 x 10 – 19 C |
|
|
Neutron |
|
1,67494 x 10 – 27 kg 0 |
|
Voir Taille des
atomes
|
|
|||
|
Nucléons |
|
A |
|
|
Proton |
|
Z |
|
|
Neutron |
|
= A – Z |
|
|
Électron |
|
= Z |
|
|
Cuivre |
|
|
|
|
Chlore |
|
|
|
|
Sodium |
|
|
|
|
Hydrogène |
|
|
|
|
Hydrogène |
|
1,67 x 10-27 kg |
|
|
Uranium |
|
3,95 x 10-25 kg |
|
|
Masse |
|
1846 mH |
|
Voir Hydrogène
/ Cuivre / Chlore
/ Sodium / Uranium
|
|
|||
|
Protons |
|
||
|
Neutrons |
|
||
|
Graphite |
|
|
|
Suite Isotopes
|
|
||
|
|
|
|
|
|
La plus proche du noyau. Les électrons y sont très liés. |
|
|
|
C'est la couche la plus éloignée du noyau. Les électrons y sont peu liés. Ce sont les
électrons périphériques. |
|
|
|
Comme si on remplissait les électrons sur les
couches successives jusqu'à saturation. Max par couche = 2 n² |
|
|
|
2 x 1² =
2 2 x 2² =
8 2 x 3² = 18 2 x 4² = 32 |
|
|
|
Le remplissage se complique avec apparition de sous-couches
et les couches o et P sont saturées à 32 électrons. |
|
|
|
(K)1 (K)2 (L)4 (K)2 (L)6 (K)2 (L)8
(M)2 |
|
|
|
(K)2 (L)8
(M)8 (N)1 |
|
|
|
(K)2 (L)8
(M)7 (K)2 (L)8
(M)8 |
|
|
|
(K)2 (L)8
(M)3 (K)2 (L)8 |
|
Voir Éléments
chimiques
|
|
||
|
Atomes;
jamais en ions. |
2 (pour Z = 2) ou 8 électrons en couche externe
qui leur confère une très grande stabilité. |
|
|
|
Règle de
l'octet respectée si:
|
|
|
|
(K)2 (L)4 Couche externe 4 électrons Compléments possible 4 électrons par apport
d'autres atomes. |
|
|
|
Chacun des atomes met en commun un électron d'une
de ses couches externes afin de former un doublet d'électrons liant les deux
atomes. |
|
|
|
(K)2 (L)4 Couche externe quatre électrons Compléments possible quatre électrons par apport
d'autres atomes. Soit quatre doublets liants |
|
|
|
||
|
|
|
|
|
|
|
|
|
|
(K)2 (L)4 forme complète 2, 4 forme abrégée |
|
|
|
12 x 1,67
10-27 = 2,004 10-26 kg |
|
|
|
6 x 1,67265 x 10 – 27 + 6 x 1,67494 x 10 – 27 + 6 x 9,109 x 10 –31 = 6 x 1,67265 x 10 – 27 + 6 x 1,67494 x 10 – 27 + 6 x 0,0009109 x 10 –27 = 6 x
3,3485009 x 10
– 27 = 2,00910054 x 10 – 26 |
|
|
|
= 2,00910054 x 10 – 26 –
2,004 x 10-26 = 0,005
par rapport à 2,004 |
|
|
|
200 mg = 200 10-6
kg 200 10-6 / 2,009
10-26
|
|
|
Masse de l'atome de carbone
selon la précision des calculs |
|
||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||
Autres exemples: FER
/ CUIVRE / ÉTAIN
![]()
|
Retour Suite |
|
|
Voir |
|
|
Aussi |
|
|
Cette page |
http://villemin.gerard.free.fr/aScience/PhyNucle/AtomeDeb.htm |