|
|||||||||||||||||||||||||||||||||
![]()
|
THERMODYNAMIQUE Les moteurs thermiques sont
mystérieux. Il y en a de plusieurs types. Quel est celui qui donne le plus de
puissance? Le problème est de trouver
la machine qui fournit le plus d'énergie mécanique. La machine qui donnera le
meilleur rendement. Un rendement supérieur à 50%, par exemple. C'est la machine à cycle fermé qui va donner la solution. |
|
|
||
|
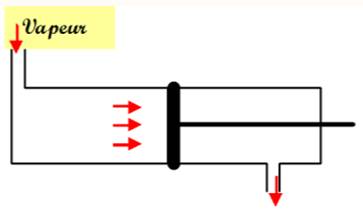
Machine
à vapeur |
Machine
thermique |
|
|
|
Le
principe de la machine thermique n'est pas si intuitif.
|
|
|
|
|
|
|
|
|
|
|
Cycle
ouvert |
Cycle
fermé |
|
|
|
|
|
|
|
|||
|
Température |
Agitation des
atomes |
|
|
|
Chaleur |
Forme d'énergie |
|
|
|
Entropie |
Qualifie
l'énergie qui se dégrade |
Mnémotechnique: Entropie =
désordre, bordel ambiant |
|
Voir Limites physiques
|
|
||
|
Principe de base |
Deux systèmes thermodynamiques en équilibre
avec un troisième sont
en équilibre entre eux. Leur propriété
commune est la température et, un échange d'énergie exige une différence de
température. |
|
|
1ier principe CONSERVATION |
Dans un système
fermé, la quantité totale d'énergie, en incluant la chaleur, est conservée.
Il y a équivalence
entre la chaleur (Q) et le travail (W) W + Q = 0 pour un
cycle thermodynamique fermé
|
|
2e principe ENTROPIE |
L’entropie d’un
système fermé sous l'effet de transformations tend à être maximum.
|
Voir Entropie de l'information
|
L'entropie
est la vérité essentielle de la nature, la tendance à la déchéance et au
désordre; en physique, en art, dans le monde du vivant … dans tous les
domaines. Le chemin vers l'anarchie. Cela peut paraître pessimiste, mais il
ne faut pas s'y tromper. C'est la plus belle chose du monde. Quand on
embrasse la vérité, on ne peut jamais se tromper. Et l'entropie, c'est la
vérité |
Extrait de Carte blanche (James Bond)
– Jeffery Deaver – J'ai Lu – 2011 – page387
|
3e principe ZÉRO ABSOLU |
L’entropie d’un
système à 0 K est nulle.
|
Anglais: Laws of thermodynamics
Voir Températures
négatives
![]()
|
Retour Suite |
|
|
Voir |
|
|
Livres |
|
|
Cette page |
http://villemin.gerard.free.fr/aScience/Thermody/ThermoBa.htm |
![]()