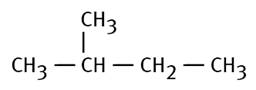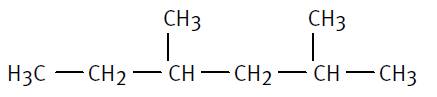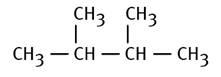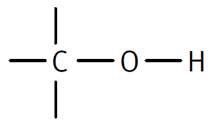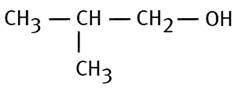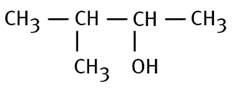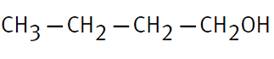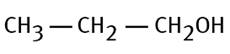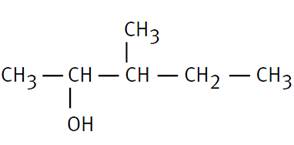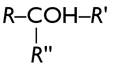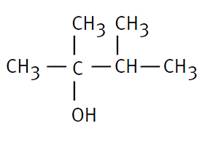|
|||||||||||||||||||||||||||||
![]()
|
ALCANES – ALKYLES – ALCOOLS Revue du cours de première. Familiarisation avec la
nomenclature des carbures saturés. |
Étymologie

Source: Étymologie du
grec et du latin du vocabulaire scientifique – Danielle De Clercq
Voir aussi: Alcool - Wiktionnaire
|
|
||
|
|
Une molécule organique contient toujours les
éléments:
et, assez souvent, les éléments:
|
|
|
|
||
|
Hydrocarbures saturés ou paraffine |
Rappel: chacun des atomes liés met en commun un électron
d'une de ses couches externes afin de former un doublet d'électrons liant les
deux atomes. |
|
|
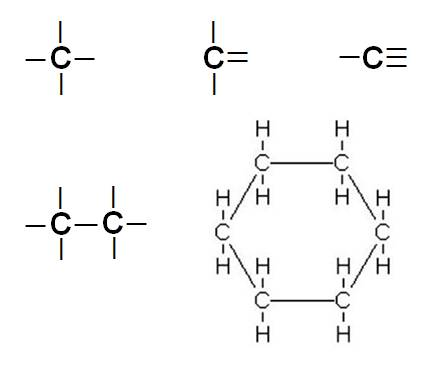
Les types de liaisons
|
La liaison triple se rencontre par exemple dans
le monoxyde de carbone. |
|
|
|
||
|
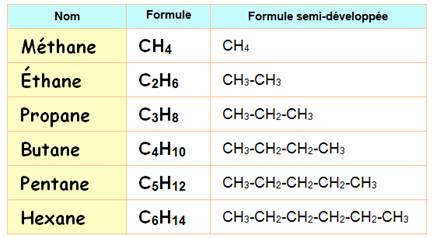
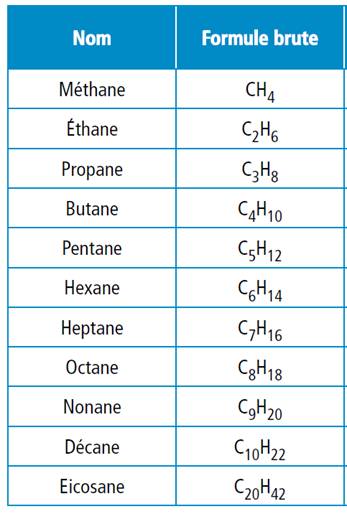
Il faut absolument retenir les quatre premiers par cœur. |
Les alcanes linéaires (ou à chaîne carbonée unique)
Autre manière de nommer l'hexane: CH3-(CH2)4-CH3 Noms jusqu'à C10
|
|
|
|
Méthane: Tous les animaux
d'élevage produisent du méthane par leurs flatulences. Cependant, les ruminants
(bœuf, mouton, chèvre) évacuent des quantités plus grandes de ces gaz que les
monogastriques (porc et volaille). Le méthane biologique, ou biogaz, contient
majoritairement du méthane; tout comme le gaz naturel d'ailleurs. Éthanol: base des boissons
alcoolisées. Il est connu, dans toutes les civilisations, depuis la plus
haute antiquité: la Bible fait allusion à la conduite scandaleuse de Noé sous
l'empire de boissons alcoolisées. Il est obtenu par fermentation directe des
sucres (hexoses) sous l'action des enzymes de certaines levures. Propane: en citernes, il
sert au chauffage domestique. Conditionné en bouteille, on le voit branché à
des parasols chauffants, des barbecues, des réchauds, des chalumeaux … Butane: il est utilisé
pour la cuisson (gazinière, four, plaque de cuisson à gaz). Facile à stocker
et transporter, il est utilisé pour les chauffages d’appoint et les
équipements nomades. |
|
|
|
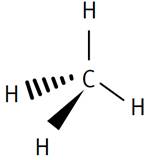
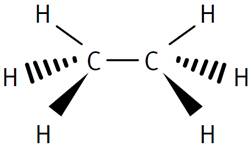
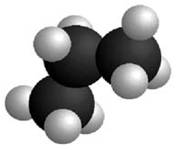
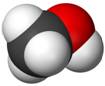
Méthane
Éthane Les traits de nature différente veulent
simplement montrer que ces liaisons sont dans l'espace. |
|
|
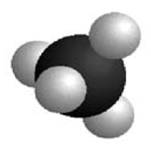
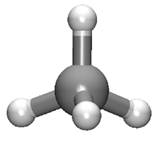
Deux représentations du méthane
Modèle compact Modèle éclaté |
|
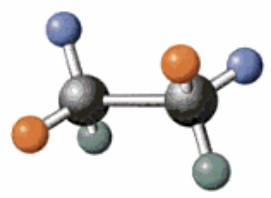
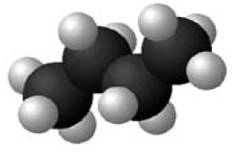
Éthane |
C2H6 ou H3C-CH3 Le hydrogènes sont
colorés (c'est une fantaisie!) |
|
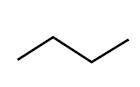
Propane et Butane |
H3C-CH2-CH3 H3C-CH2-CH2-CH3 |
|
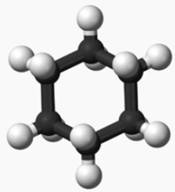
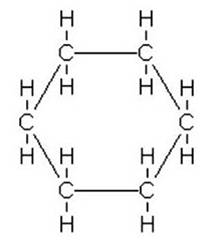
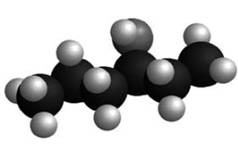
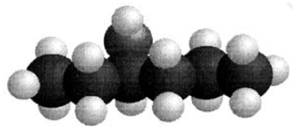
Hexane |
L'extraction par des solvants volatils consiste à
dissoudre la matière odorante de la plante dans un solvant que l'on fait
ensuite évaporer. Cette technique pratiquée dès le 18ème siècle avec de
l'éther, produit coûteux et fortement inflammable, utilise de nos jours des
solvants plus adaptés comme l'hexane ou l'éthanol. Source Fragonard |
|
|
C6H12 |
|
|
|||
|
|
Alkyles = Alcane – 1 atome hydrogène Méthyle = -CH3 |
||
|
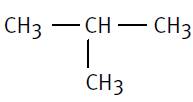
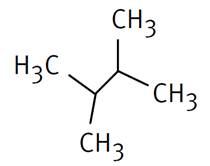
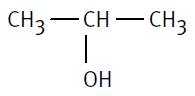
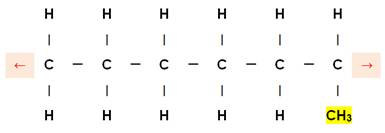
Ici: 2-méthylpropane |
|
Propane et sur le 2e carbone on trouve un méthyle |
|
|
2-méthylbutane |
|
||
|
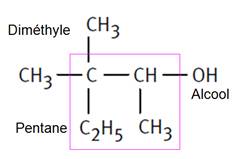
2,4-diméthylhexane que l'on prendra plutôt que 3,5-diméthylhexane |
La chaîne
carbonée contient 6 atomes de carbone ; il s’agit de l’hexane. Il y
a, de plus, 2 radicaux méthyles qu’on appellera diméthyl.
La chaîne carbonée est numérotée de la droite vers la gauche de manière à ce
que les éléments ajoutés aient les indices de position les plus petits. En pratique: principe de numérotation
Après avoir
choisi la chaine carbonée la plus longue, on cherche le supplément (alcool ou
alkyle) le plus proche d'un bout et on numérote les carbone (une fois pour
toute) à partir ce là. La chaine carbonée est présentée volontairement tordue pour illustre le principe du choix
de la plus longue. |
||
|
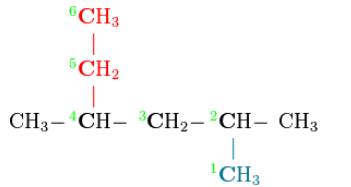
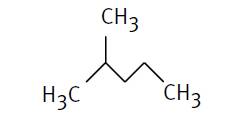
Ici: 2-méthylpentane |
|
Méthyl sur 2e carbone du pentane CH3 CH3-CH2-CH2-CH2-CH3 Les deux CH2 ne sont mentionnés que par les
sommets de la ligne brisée. |
|
|
2,3-diméthylbutane |
|
Deux méthyles en 2e et 3e
positions sur un butane
CH3 CH3-CH2-CH2-CH3 CH3 Moins les H aux ramifications Les deux nœuds symbolisent des carbone
avec CH non représentés. |
|
|
|
Voici la formule dévoloppée |
||
|
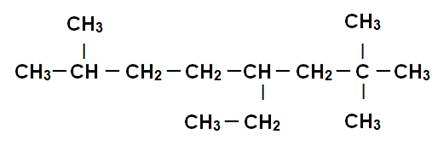
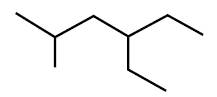
4-éthyl -2,2,7-triméthyloctane |
|
||
Note
|
C2H4
est l'éthylène. Les carbones sont liés par
une double liaison covalente. De tels hydrocarbures sont les alcènes en C2H2n. |
|
|
|||
|
Nature |
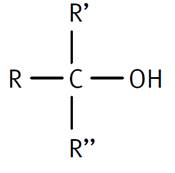
Alcane avec 1 Hydrogène remplacé par 1 OH (hydroxyle) |
||
|
Groupe caractéristique
alcool |
|
||
|
La formule générale d’un
alcool à chaîne carbonée saturée et non
cyclique est donc: |
CnH2n+1OH |
||
|
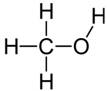
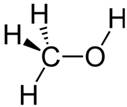
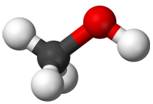
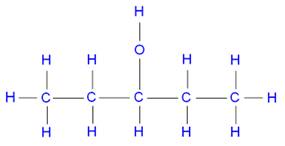
Alcool le plus simple et
toutes ses représentations Méthanol Méthan-1-ol CH4O CH3OH H3C-OH |
|
|
|
|
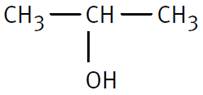
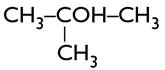
Propan-2-ol |
|
||
|
2-méthylpropan-1-ol |
|
||
|
3-méthylbutan-2-ol |
Priorité à OH pour le numéro le plus petit, |
||
|
3-méthylpentan-2-ol |
|
||
|
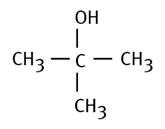
Méthylpropan-2-ol |
La structure
"linéaire" des alcanes est parfois cachée. On cherche la plus
longue chaîne en C. |
||
|
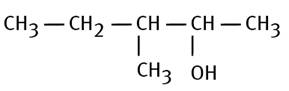
Alcool tertiaire 3-diméthylpentan-2-ol |
|
||
|
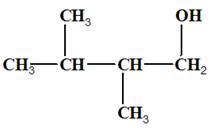
2-méthylbutan-1-ol |
|
||
C
|
|
||
|
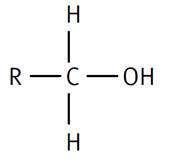
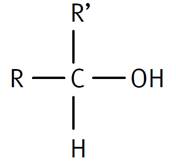
Primaire R-CH2-OH COH est lié à un groupement carboné |
|
|
|
Méthanol |
CH3-OH |
|
|
Éthannol |
CH3-CH2-OH |
|
|
Butan-1-ol |
|
|
|
Pentan-1-ol |
CH3-CH2-CH2-CH2-CH2OH |
|
|
Propan-1-ol |
|
|
|
2,3-diméthylbutan-1-ol |
|
|
|
Hexan-3-ol |
|
|
|
Secondaire R – CHOH – R' COH est lié à deux groupements carbonés |
|
|
Propan-2-ol: |
|
|
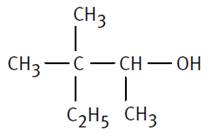
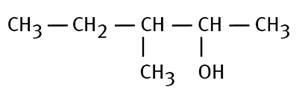
3-méthylpentan-2-ol |
|
|
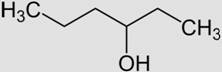
Pentan-3-ol Famille des
pentanols (isomère du
pentanol) |
Formule brute: C5H12O |
|
Hexan-3-ol 3 Hexanol (Arôme des
ananas) |
Formule brute: C6H14O Il existe 34 formules développées pour cette formule brute
(isomères) |
|
Tertiaire
COH est lié à trois groupements carbonés |
|
|
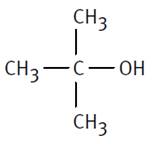
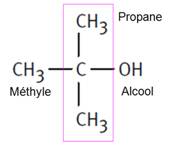
2−méthylpropan−2−ol |
|
|
2,3-diméthylbutan-2-ol |
|
|
|
||
|
|
Butane: quatre sommets de la ligne brisée: C4H10
3-éthyl-5-méthylhexane: C9H20 Ligne brisée horizontale: hexane: C6H14 En 1 ou 5, méthyle: C H3 En 3 ou 4, 2 branches, soit éthyle: C2H5 Moins les branchements
-H2 L'éthyle avec plus de carbone l'emporte sur le méthyle et prend le
numéro le plus petit prioritaire. Soit 3 pour éthyle et 5 qui en découle pour le méthyle
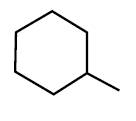
Méthylcyclohexane: C7H14
avec hexane : C6H14 avec méthyle: CH3 moins 2H pour enrouler les C sur eux-mêmes et moins 1H pour y loger le radical méthyle
|
|
|
|
|
|
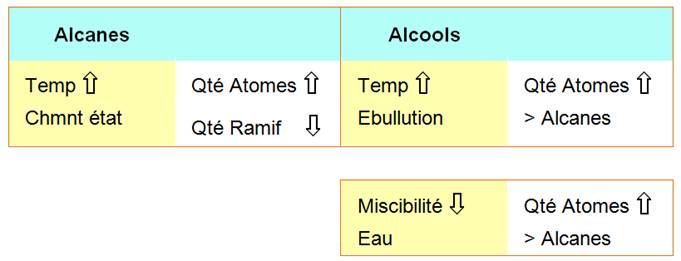
Résumé
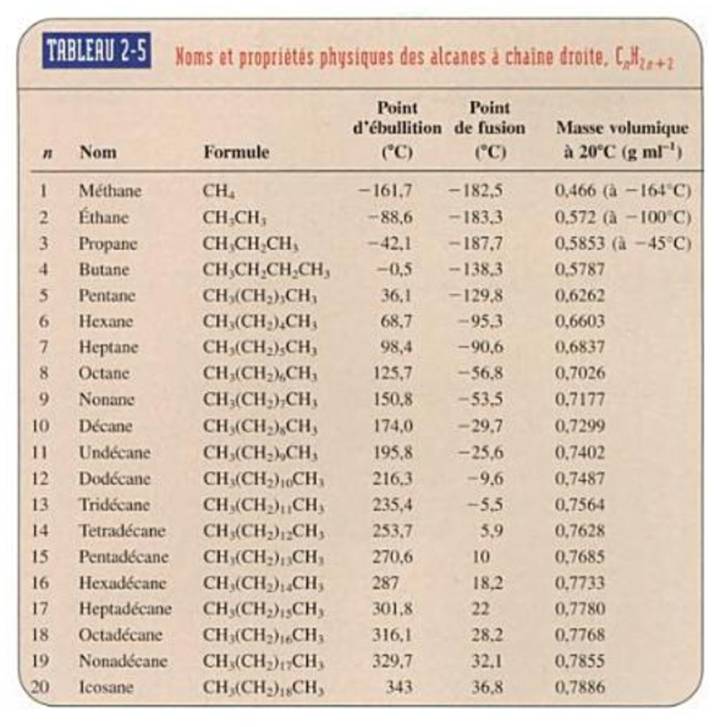
Exemples: propriétés des alcanes
Source: Traité
de chimie organique – Vollhard & Shore – ebook |
|
Voir Préfixes grecs des
nombres
|
|
||
|
Données |
Masses
molaires atomiques de l’hydrogène (1g.mol-1),
du
carbone (12g.mol-1) et de
l’oxygène (16 g.mol-1). |
|
|
Masse
molaire d’un alcane à n+1 atomes de carbone |
Formule:
Cn+1H2n+4 M
= 12(n+1) + 2n + 4 = 14n + 16 |
|
|
Masse molaire d’un alcool à
n atomes de carbone |
Formule:
CnH2n+1-OH M
= 12n + 2n + 1 + 16 + 1= 14n + 18 |
|
|
Comparaison |
Les
masses molaires d’un alcane à (n+1) atomes de carbone et d’un alcool à n
atomes de carbone sont voisines. |
|
1
![]()
|
Suite |
|
|
Voir |
|
|
Références |
|
|
Cette page |
http://villemin.gerard.free.fr/aScience/Chimie/aaaORGAN/Alcanes.htm |
![]()